André Luís Teixeira Fernandes
Eduardo Mosca
Rodrigo Ticle Ferreira
Engenheiros agrônomos, C3 Consultoria e Pesquisa
A cafeicultura é uma das mais importantes atividades agrícolas do Brasil, que é o maior produtor mundial. No entanto, há alguns fatores que vêm comprometendo o seu rendimento, principalmente aqueles relacionados aos aspectos fitossanitários, por exemplo, o ataque de nematoides, que são fitoparasitas limitantes ao cultivo do cafeeiro, principalmente em solos arenosos, com baixa fertilidade e deficiência hÃdrica.
Várias espécies de nematoides estão associadas à cultura do café, mas os gêneros Meloidogyne e Pratylenchus são comprovadamente nocivos. Há uma estimativa de que a redução da produção mundial de café, devido à ação dos nematoides, seja, em média, de 15%. No Brasil, estima-se um valor médio de 20%. Na Tabela 1 constam os principais nematoides encontrados no Brasil.

Tabela 1 ““ Principais espécies de Meloidogyne associadas ao cafeeiro no Brasil e sua distribuição geográfica
| Espécie | Distribuição geográfica |
| M. exÃgua | Amplamente disseminada em todas as regiões cafeeiras |
| M. caffeicola | Minas Gerais, Paraná e São Paulo |
| M. incognita | Espírito Santo, Minas Gerais, Paraná e São Paulo |
| M. hapla | São Paulo |
| M. paranaensis | Goiás, Minas Gerais, Paraná e São Paulo |
Fonte: Boletim Técnico – Nematoides Parasitos do Cafeeiro (Instituto Biológico, 2018)
Danos
Por ser uma cultura perene, o cafeeiro propicia condições para o aumento da população de nematoides praticamente durante o ano todo, podendo afetar todas as fases fenológicas do cafeeiro.
Por esses motivos, o decréscimo nas produtividades tem se tornado um dado frequente nas lavouras cafeeiras infestadas por fitonematoides. Na literatura, há evidências que, ao realizar o controle deste patógeno, o potencial produtivo das plantas pode aumentar.
Santinato et al. (2013), realizando o controle químico de Meloidogyneexigua em mudas de café, observaram aumento de 76% no volume de raízes. Este maior volume propicia aumento significativo na absorção de água, macro e micronutrientes. Resultados como estes vêm respaldando o controle deste patógeno em lavouras cafeeiras.
Ao atacar o sistema radicular do cafeeiro, os nematoides tornam as plantas fracas e improdutivas, dificultando a absorção de água e sais minerais, causando morte das raízes, queda das folhas, diminuição da produção e até a morte das plantas. Interferem também no controle da ferrugem e do bicho mineiro, quando se usam produtos (fungicida+inseticida) via solo.

Pesquisas
Diversos estudos demonstram a importância de se proceder ao controle dos nematoides na cafeicultura. Sabe-se também que existem várias metodologias disponíveis para aplicar os nematicidas, como via drench, considerada a mais comum.
Entretanto, com a ampliação das áreas irrigadas, profissionais estão posicionando a aplicação de nematicida via gotejo. Diante disso, conduziu-se um experimento de campo com o objetivo de avaliar o uso do Nimitz aplicado via gotejo no controle de nematoides no cafeeiro.
O ensaio foi conduzido em duas lavouras (3ª e 8ª safra), localizadas no município de Varjão de Minas (MG), sendo composto por sete tratamentos, dentre eles o controle, sem aplicação de nematicida e cinco doses de Nimitz (1,0; 1,5; 1,75; 2,0 e 2,5 l ha-1) aplicado via gotejo e o controle positivo, com a aplicação de Cadusafós via drench.

Irrigação
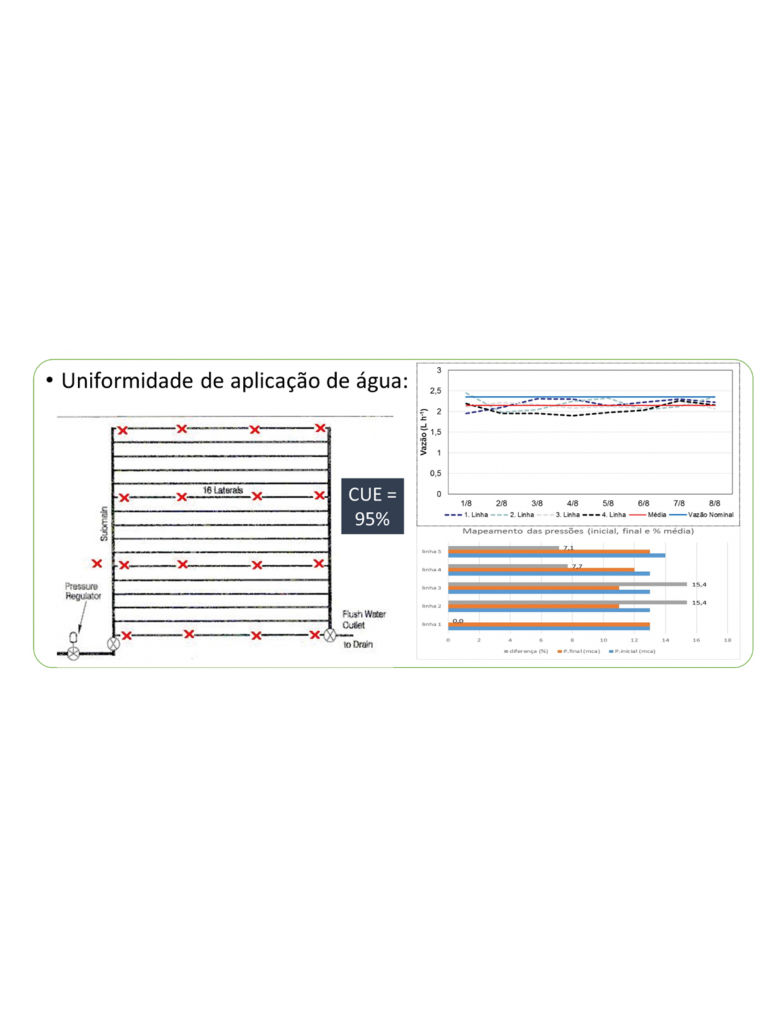
A irrigação foi realizada pelo sistema de gotejamento, sendo este superficial. Anteriormente à aplicação dos tratamentos, foi realizada uma avaliação do sistema de irrigação por gotejamento, com a determinação da uniformidade de aplicação de água.
Na Figura 1 consta como foram realizadas as avaliações de vazão, pressão e os resultados finais. A uniformidade ficou acima de 95%, o que permite a aplicação dos nematicidas via sistema de gotejamento com excelente distribuição.
Figura 1 ““ Avaliação do sistema de irrigação por gotejamento

O manejo da irrigação foi feito a partir de medições de temperatura e precipitação, calculando-se o balanço hídrico climatológico. A variedade na qual o experimento foi conduzido é a Catuaà IAC 144.
A lavoura nova está na 3ª safra, em produção, plantio realizado em abril de 2012, no espaçamento 4,00 x 0,50 m (estande de 5.000 plantas ha-1). A lavoura mais antiga está na 8ª safra, plantio realizado em 2007, no espaçamento 4,00 x 0,50 m (estande de 5.000 plantas ha-1). Nas Tabelas 1 e 2 constam avaliações dos nematoides nas duas lavouras antes do início do experimento.
Tabela 1. Presença de Meloidogyne exigua1 na lavoura nova, antes da instalação do ensaio, em novembro de 2015
| Blocos | ……. Região do bulbo do gotejador ……. | |||
| Meloidogyneexigua J2 | Ovos de nematoides | |||
| Solo | Raiz | Solo | Raiz | |
| 1 | 120 | 452 | 16 | 432 |
| 2 | 135 | 543 | 12 | 407 |
| 3 | 180 | 491 | 24 | 501 |
| 4 | 101 | 389 | 16 | 587 |
| 5 | 95 | 476 | 36 | 540 |
| Blocos | ….. Região a 30 cm do bulbo do gotejador …… | |||
| Meloidogyneexigua J2 | Ovos de nematoides | |||
| Solo | Raiz | Solo | Raiz | |
| 1 | 34 | 104 | 8 | 8 |
| 2 | 32 | 89 | 4 | 0 |
| 3 | 46 | 75 | 0 | 12 |
| 4 | 29 | 98 | 4 | 8 |
| 5 | 45 | 82 | 4 | 25 |
1Extração de nematoides pela técnica da centrifugação em solução de sacarose, seguida de observação em microscópio ótico (Jenkins/Coolen&Hard ““ (100 cm3) de solo (10g) de raízes). Data da coleta – novembro de 2015
Tabela 2. Presença de Meloidogyne exigua1 na lavoura velha, antes da instalação do ensaio, em novembro de 2015
| Blocos | ……. Região do bulbo do gotejador ……. | |||
| Meloidogyneexigua J2 | Ovos de nematoides | |||
| Solo | Raiz | Solo | Raiz | |
| 1 | 154 | 358 | 24 | 542 |
| 2 | 165 | 445 | 20 | 465 |
| 3 | 125 | 545 | 15 | 405 |
| 4 | 115 | 425 | 18 | 524 |
| 5 | 101 | 385 | 12 | 425 |
| Blocos | ….. Região a 30 cm do Bulbo do gotejador …… | |||
| Meloidogyneexigua J2 | Ovos de nematoides | |||
| Solo | Raiz | Solo | Raiz | |
| 1 | 25 | 85 | 4 | 12 |
| 2 | 30 | 95 | 8 | 6 |
| 3 | 28 | 70 | 0 | 4 |
| 4 | 22 | 94 | 6 | 8 |
| 5 | 25 | 75 | 4 | 12 |
1Extração de nematoides pela técnica da centrifugação em solução de sacarose, seguida de observação em microscópio ótico (Jenkins/Coolen& Hard ““ (100 cm3) de solo (10g) de raízes). Data da coleta – novembro de 2015